ACIDOS
CARBOXILICOS
Los ácidos
carboxílicos constituyen un grupo de compuestos, caracterizados
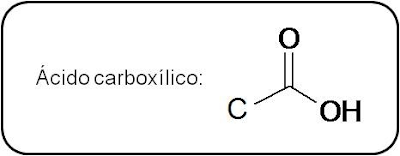
porque poseen un grupo funcional cuyo nombre es grupo carboxilo o grupo carboxi (–COOH). En el grupo funcional carboxilo
coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O). Se puede representar como -COOH o -CO2H.
El
grupo carboxilo es el responsable de la polaridad de la molécula y de la
posibilidad de establecer enlaces de hidrógeno. El hidrógeno del hidroxilo
puede disociarse y el compuesto se comporta como un ácido. Esta disociación se
ve favorecida por la resonancia del ión carboxilato, ya que el doble enlace se
des localiza y la carga negativa se distribuye entre los dos átomos de oxígeno.
Se
caracterizan por estar formados por un conjunto
de átomos unidos entre sí mediante enlaces covalentes
carbono-carbono, denominado grupo carboxilo,
que cuando se unen a otros elementos como hidrógeno, oxígeno o nitrógeno, integran una infinidad de
compuestos diferentes.
Estos ácidos se clasifican de acuerdo a la cantidad
de grupos carboxilos que posea cada átomo:
- Monocarboxílicos, una molécula contiene un solo grupo
carboxilo, como por ejemplo el ácido fórmico, acético, palmítico,
esteárico, valérico.
- Dicarboxílicos, cada átomo incluye dos grupos
carboxilos, entre ellos están el ácido oxálico, malónico,
glutárico, adípico, pimélico, subérico, sebácico.
- Tricarboxílicos
o policarboxílicos, una misma partícula dispone
de tres grupos carboxilos, prototipo
de ello son el ácido cítrico, aconítico, tricarbalítico.